Date: June 2019
膵臓癌は 9 番目に多く診断される癌で、致死率も非常に高く、5 年生存率は 5-8% にとどまっています。[1,2,3] 米国癌協会 (American Cancer Society) の推定によると、今年だけでも 56,770 人が新たにこの病気にかかり、 45,750人以上が命を落とすと言われています。 Pancreatic ductal adenocarcinoma (PDAC) being the most prevalent and aggressive form of exocrine pancreatic cancer accounts for ~90% of cases with mortality equaling incidence.[4,5]
診断の時点で、PDAC 患者様の大半は局所進行性疾患、切除不能疾患、あるいは転移性疾患を患っています。早期発見を難しくし、生存率を低下させている理由として、この病気が静かに進行すること、疾患特有の症状が進行期まで表れないことがあります。切除可能な患者様への治療オプションには、手術とその後の初回全身化学療法(ゲムシタビン、FOLFIRINOX、パクリタキセル)または併用化学放射線療法が挙げられます。局所進行性、切除不能な患者様の療法には多剤化学療法(5-FU、オキサリプラチン、イリノテカン)または化学放射線療法が含まれます。[6] これらの治療法は膵臓癌の患者様にはメリットが限定的なため、免疫療法薬などの新しいオプションが現在臨床試験でテスト中です。
PDAC は線維性間質の存在、遺伝子変異量の低さ、CD8+ T 細胞の浸潤の欠如、免疫抑制性骨髄細胞集団の存在など、典型的な非免疫原性腫瘍の特性を特徴とします。[7] 治療反応を高めるための現在のアプローチは、放射線療法(RT)などの薬剤を使って腫瘍への T 細胞の行き来を増加させることに焦点を当てています。ほとんどの固形腫瘍では、RT 単独でも免疫系を活性化させ、細胞毒性死および免疫刺激シグナルの放出後に抗腫瘍免疫応答を誘発する可能性があります。しかし PDAC 患者様の場合は、高濃度の RT 単独でも化学療法剤との併用治療でもおおむね良い結果は得られず[8]、単剤免疫療法剤を使った治験でも奏効率が 1-2% と低いことが示されています。[9] 現在、少なくとも 21 件のオープン治験で RT と他の免疫刺激剤との組み合わせが調査されており、これは PDAC 治療における有望な手段であり、さらなる研究の価値があると言えるでしょう。[10] 同様に、前臨床のプラットフォームにおいて当社は Pan02 マウスの PDAC モデルを使った単独療法および併用療法の評価を行っています。Pan02 は オス C57BL/6 マウスにおける 3-MCA(3-メチルコラントレン)による化学誘導によって開発された、定評あるグレード Ⅲ 腺癌モデルです。[11] この注目のモデルでは、Pan02 腫瘍モデルの増殖動態、免疫調節抗体に対する反応、焦点放射線、そしてRTと免疫調整剤との組み合わせを、C57BL/6 マウス系統で実験した in vivo データを紹介します。
Pan02 増殖パラメータ
Pan02 の皮下移植によって確立された腫瘍の平均倍加時間は 4~5 日間で、マウスは移植後 ~30 日間研究対象になり(図 1)、その間体重の減少は見られませんでした(データ未掲載)。増殖動態により、このモデルの抗腫瘍反応の評価に 3 週間以上の治療可能時間域が考慮されました。

フローサイトメトリーによる Pan02 腫瘍の免疫表現型分析では、腫瘍へのリンパ性細胞浸潤が不良であることが確認されました(図 2)。 While CD8+ and CD4+ helper T cells constituted only 1.6% and 1% of the CD45+ population, respectively, the immunosuppressive myeloid cell populations were present in abundance.M-MDSC、M1、および M2TAM が優勢な細胞亜集団でした。この腫瘍免疫プロファイルは非免疫原性または「冷たい」腫瘍モデルの特徴で、PDAC 患者様に観察されるものと似通っています。

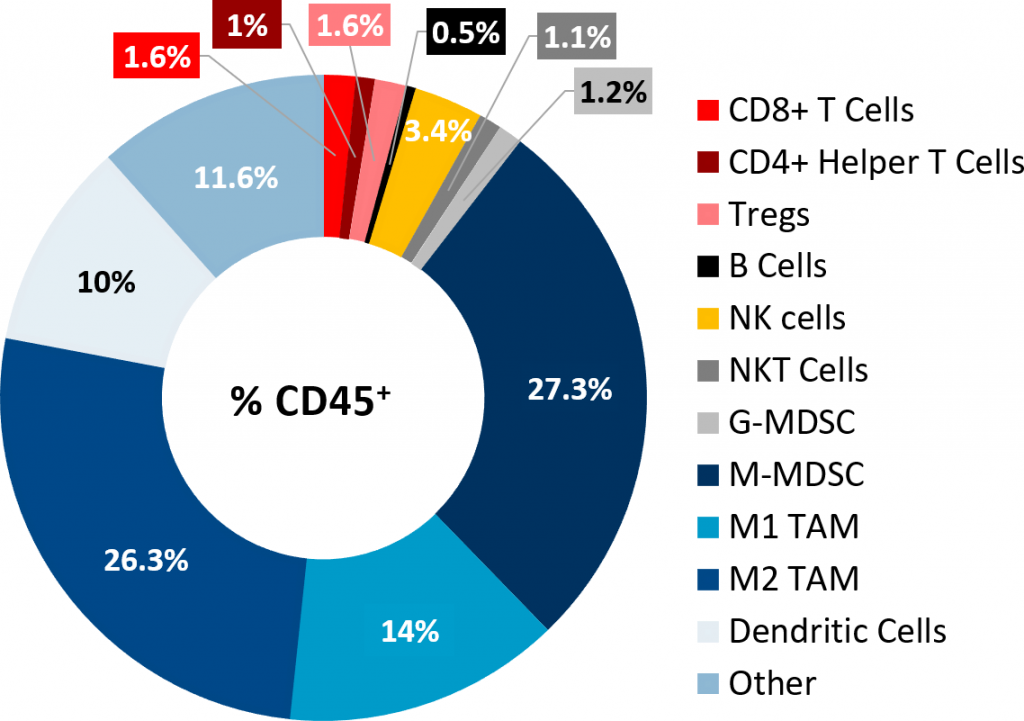
図 2:皮下 Pan02 腫瘍の腫瘍免疫プロファイル
単剤治療に対する Pan02 の反応
膵臓癌患者に最も一般的に用いられる化学療法の一つ、ゲムシタビン(100mg/kg、Q3Dx4)を使用した Pan02 担癌マウスの単剤治療は、忍容性が高く、また統計的に有意な腫瘍増殖遅延(TGD)を引き起こしました(図 3)。

図 3:ゲムシタビンに対する Pan02 の反応
PDAC の臨床的な免疫療法の調査を前提に、種々の免疫調節抗体に対する当社の Pan02 モデルの応答性を評価することを開始しました(図 4)。しかしながら、Pan02 腫瘍の免疫抑制プロファイルに一致して、このモデルがチェックポイント阻害剤の抗 mPD-1、抗 mPD-L1、抗 mCTLA-4、そして共刺激抗体の抗 mCD137 と 抗 mOX40 に対する反応が最小限または無応答であったことは驚くに値しません。 すべての抗体は週 2 回 10mg/kg づつ、合計 4 回投与されました(図 4)。

図 4:免疫調節抗体に対する Pan02 の反応
放射線療法と併用療法に対する Pan02 の反応
放射線療法は一般的に PDAC 患者様によく行われます。当社のモデルでは、局所放射線の単回照射(5Gy または 10Gy)を直接腫瘍に送達するために、小動物放射線研究プラットフォーム(SARRP: Xstrahl)が採用されました。その結果、無治療対照群と比べて、用量依存的にそれぞれ 9.5 日および 22 日間の腫瘍増殖遅延が見られました(図 5)。
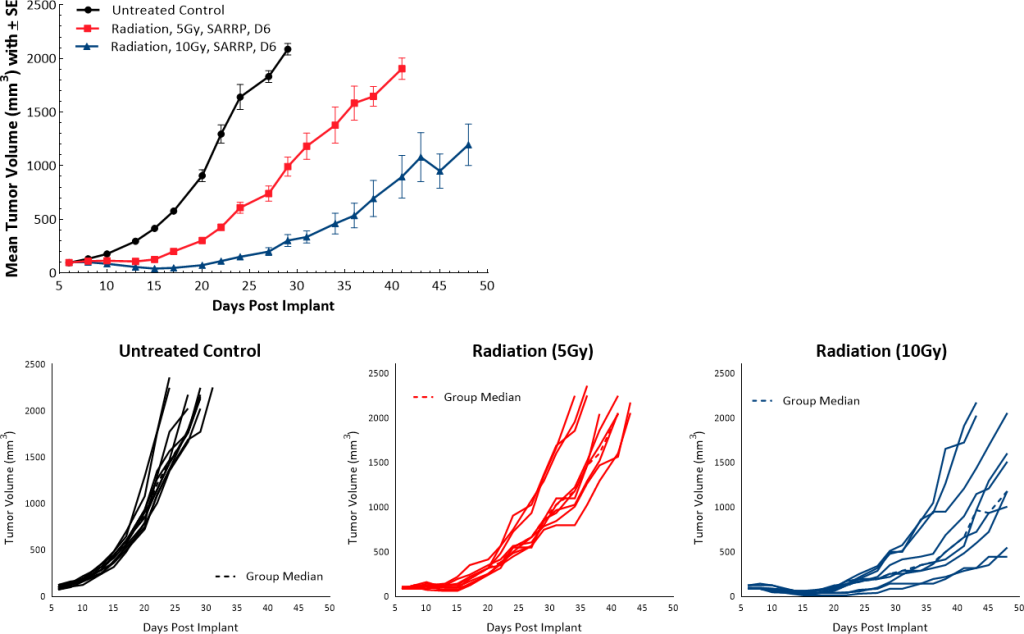
図 5:焦点放射に対する Pan02 の反応
RT とチェックポイント阻害剤を組み合わせた抗腫瘍効果を調査するため、5Gy の単回照射と抗 mPD-1 または抗 mPD-L1 抗体が使用されました。無治療とアイソトープの対照群は重複した増殖率を見せ、単剤チェックポイント阻害剤の抗 mPD-1 と抗 mPD-L1 では抗腫瘍反応を誘発しませんでした。5Gy の単回照射の RT が無治療対照群と比べて 9.5 日間の腫瘍増殖遅延をもたらしたのに対し、チェックポイント阻害剤と組み合わせた RT は抗腫瘍反応の向上にそれほど寄与しませんでした。RT と抗 mPD-1 もしくは抗 PD-L1 との組み合わせはそれぞれ 13 日間と 11.2 日間の腫瘍増殖遅延になりました(図 6)。
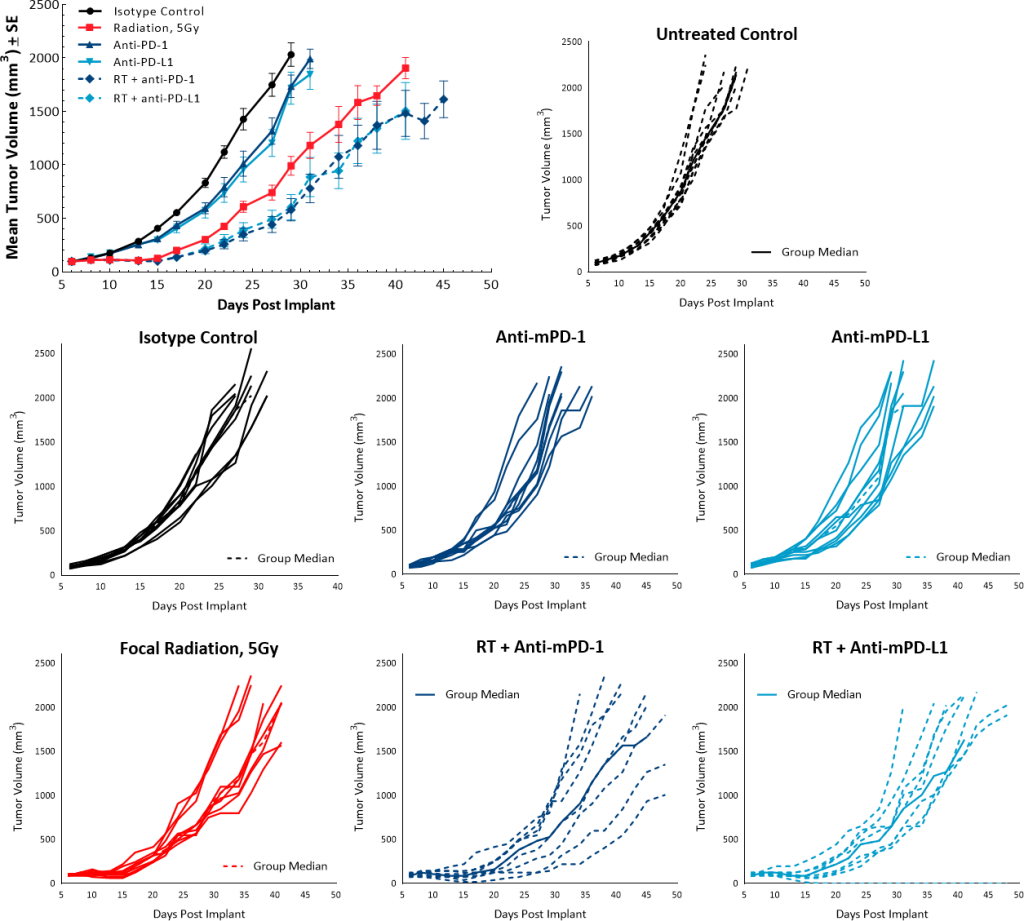
図 6:放射線とチェックポイント阻害剤の組み合わせに対する Pan02 の反応
Pan02 モデルの今後の研究
皮下 Pan02 モデルにおける治療反応を向上させるため、複数の組み合わせを使用する可能性を評価する研究が進行中です。さらに最近、当社は同所性環境での研究をサポートするために、ルシフェラーゼ対応の Pan02 細胞株を生成しました。
参照
2SEER Cancer Stat Facts. National Cancer Institute(アメリカ国立がん研究所), NIH. (https://www.cancer.gov).
3Pancreatic Cancer Action Network (https://www.pancan.org/).
4Gunderson AJ, Yamazaki T, McCarty K et al. Blockade of fibroblast activation protein in combination with radiation treatment in murine models of pancreatic adenocarcinoma. Plos One 2019, 14(2): e0211117.
5Kabacaoglu D, Ciecielski KJ, Ruess DA and Algul H. Immune checkpoint inhibition for pancreatic ductal adenocarcinoma: current limitations and future options. Frontiers in Immunology 2018, 9:1876.
6Saung MT and Zheng L. Current standards of chemotherapy for Pancreatic cancer. Clin. Ther. 2017,39(11):2125-2134.
7Azad A, Lim SY, D’Costa Z et al. PD-L1 blockade enhances response of pancreatic ductal adenocarcinoma to radiotherapy. EMBO, Molecular Medicine 2017, 9(2):167-180.
8Lauffer DC, Kuhn PA, Kueng M et al. Pancreatic cancer: Feasibility and outcome after radio-chemotherapy with high dose radiotherapy for non-resected and R1 resected patients. 2018. Cureus 10(5): e2713.
9Javle M, Golan T and Maitra A. Changing the course of pancreatic cancer – focus on recent translational advances. Cancer Treatment Reviews. 2016; 44:17-25.
10Gajiwala S, Torgeson A, Garrido-Laguna I, Kinsey C, and Lloyd S. Combination immunotherapy and radiation therapy strategies for pancreatic cancer – Targeting multiple steps in the cancer immunity cycle. J Gastro Oncol, 2018; 9(6):1014-1026.
お問い合わせはこちら
お問い合わせ