著者:Maryland Franklin 博士 | サイエンティフィック・ディベロップメント部門バイスプレジデント
Date: October 2019
肺癌は米国の男女両方において 2 番目によく見られる癌で、癌関連死のなかでは圧倒的に大きな原因とされています。アメリカ癌協会は、2019年には228,150件の新しい肺癌ケースが診断され(男性が116,440人 、女性が111,710人)、 142,670人が亡くなる(男性が76,650人、女性が 66,020人)と予想しています。
肺癌の死亡者数は2005年に159,292人でピークに達し、そこからは緩やかな減少傾向にあります。[1] しかし、肺癌の5年生存率はわずか 20%ほどで、他の癌に比べると大幅に低い確率になっています。早期発見できた肺癌に関しては、5年生存率は~56%まで上がりますが、肺癌を早期発見できる確率はわずか~16%程です。発見が遅れると5年生存率は最低で5%まで落ち込みます。
肺がんの治療には、診断されているのがどのようなタイプの肺癌か、また病気がどのステージかに応じて、様々な選択肢があります。臨床では手術、化学療法、放射線、標的療法、また免疫療法が使用されています。一部の事例では、特定の遺伝子変異や、またもっと最近では最新の免疫療法が特に成果を上げていますが、全体的に見れば予後はまだまだ不良です。したがって、新しい肺癌の治療法の開発が引き続き必要です。
免疫療法の出現によりimmuno-oncology療法の開発をさらに進歩させるため同系マウス腫瘍モデルが必要になりました。 これらのモデルのうちの 1 つが新薬の開発をサポートするためラボコープによって特性化された、LL/2(ルイス・ラング)肺癌モデルです。LL/2 細胞株は,C57BLマウスの肺に扁平上皮癌として自然増殖したルイス肺癌モデルに由来する原発性腫瘍小結節から開発されました。下記に説明されているとおり、LL/2はT細胞の浸潤性が低く、骨髄性抑制性細胞の浸潤性が高い、「冷たい」腫瘍に位置付けられています。多くの患者において、現行の免疫療法に対する反応が見られない現在、「冷たい」腫瘍モデルを理解することは、治療薬発見および開発のため同系マウスアプローチを開発また利用する上で、重要な要素となっています。
LL/2 腫瘍免疫プロフィール
LL/2 腫瘍浸潤のベースライン免疫プロファイルは、ラボコープの CompLeukocyteTM パッケージを使って解析された 6 個の非治療腫瘍(~500mm3)によって確定されました。これらの腫瘍を浸潤するCD45+ 細胞のうち、M-MDSCは最大の細胞個体数を持ち(37%)、次がG-MDSC(22%)、そしてM2 TAM(20%と続きます。T細胞(CD8+ および CD4+の両方)、またM1 TAM, B細胞, NK, NKT および樹状細胞は微小な割合で存在しています(図表1)。全体のプロフィールは非免疫原性モデルを示唆しています。
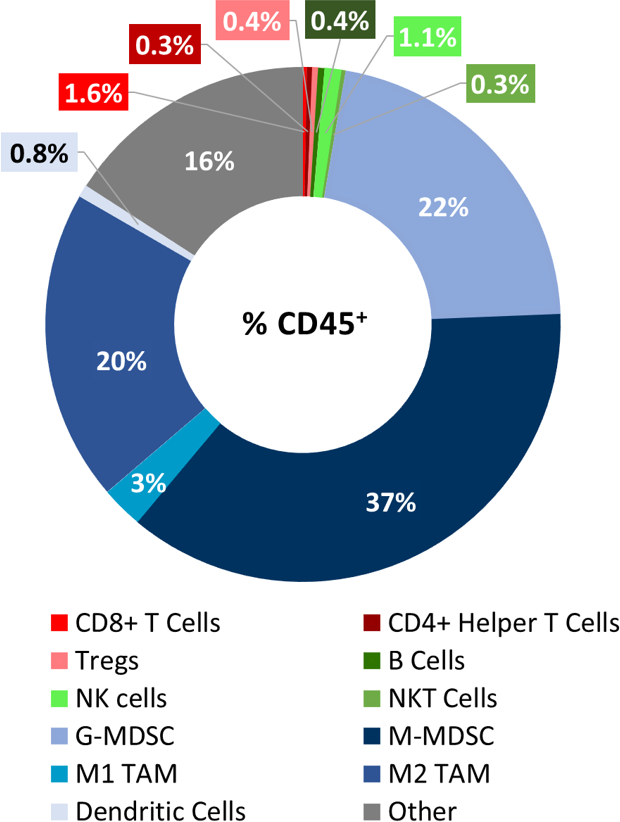
図表 1: LL/2 モデルにおける腫瘍免疫細胞浸潤の免疫表現型検査
LL/2 増殖と 治療に対する反応
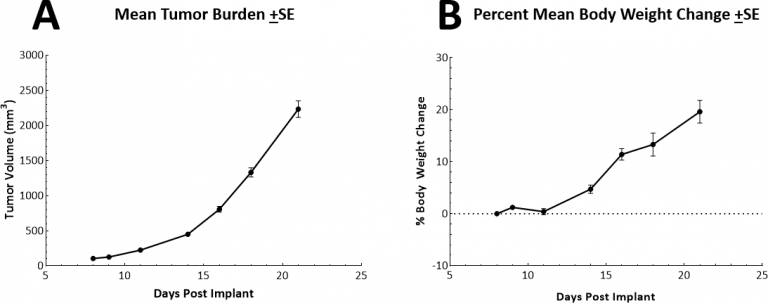
皮下 (SC) LL/2 腫瘍のIN VIVO 倍加時間はおよそ2.5-3 日間と、非常に急速です。このことから、抗腫瘍活性を引き出す試験剤に最大 2 週間の投与期間を利用できるモデルとなります。モデル本体では体重の減少に寄与しませんでした(図表2A, 2B)。
肺癌には様々な種類の化学療法アプローチがあり、その目的から当社はドキソルビシンとパクリタキセルの両方を単剤として LL/2モデルで試験しました。ドキソルビシンは、広範囲の抗腫瘍活動を示すアントラサイクリンで、パクリタキセルは非小細胞肺癌の治療に広く用いられるチューブリン結合剤です。LL/2 モデルにおいては、どちらの試験も当社が設定したスケジュールおよび投与量の範囲内では有意義な抗腫瘍反応を示しませんでした(図表3AとB)。
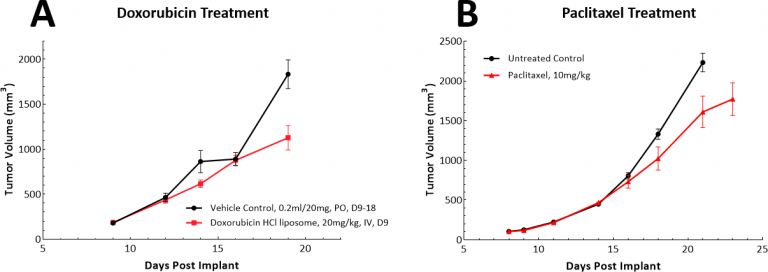
図表3: 単剤ドキソルビシンまたはパクリタキセル治療に対するLL/2SC腫瘍の反応
免疫療法の出現により、当社では単剤チェックポイント阻害剤、抗PD-1 または抗PD-L1 に対してLL/2モデルが反応するかどうかも検証しました(図表4)。図表4はアイソタイプコントロール、抗PD-1 ないしanti-PD-L1で治療をした後の平均腫瘍容積(図表4A)および個々の腫瘍容積(図表4B、C、D)を示しています。すべての実験薬の投与は腫瘍が( ~100mm3)まで確立した後に行っています。予期したとおりどちらの実験薬も、このモデルでは高い免疫抑制性腫瘍の微小環境が影響し、治療効果は見受けられませんでした。当社は次に、パクリタキセルと免疫チェックポイント阻害剤の組み合わせが併用効果を生み出すかを推論しました(図表5A&B)。しかしながらこのアプローチはマウスにとって転帰好転には繋がらず、このモデルが「冷たい」表現型を持つという意見を支持するものとなりました。ただし、3種配合アプローチがこのモデルにおいて効果を上げる可能性もあり、さらに「冷たい」腫瘍を管理するアプローチを求めているお客様にはこのモデルは有用だと言えます。
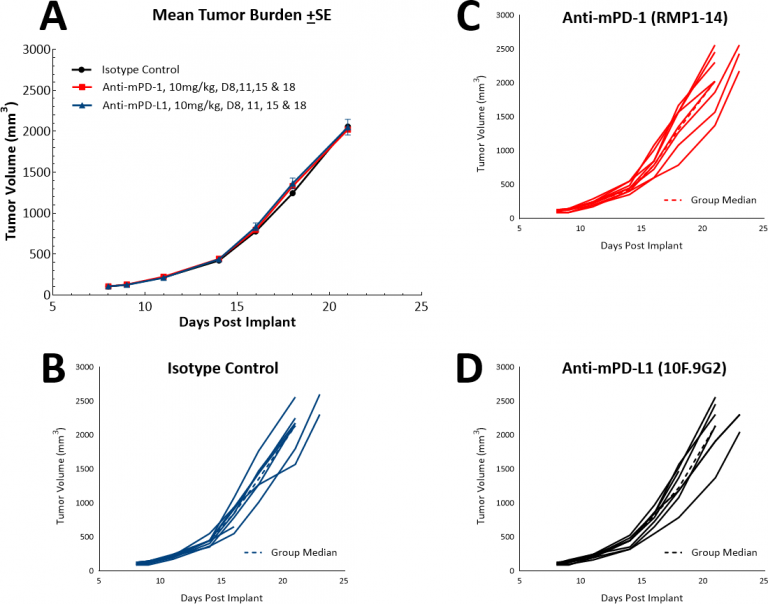
図表4: 単剤チェックポイント阻害剤、抗mPD-1 と 抗mPD-L1に対するLL/2 SC腫瘍の反応
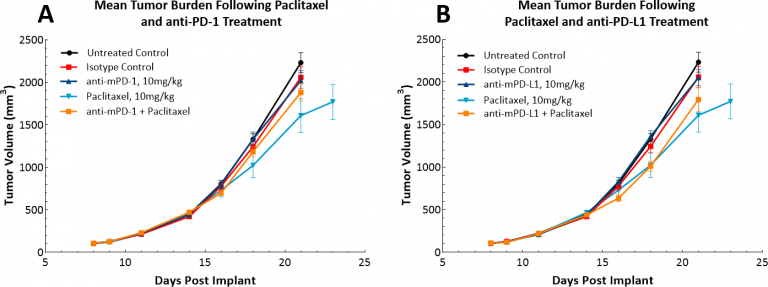
図表5: チェックポイント阻害剤とパクリタキセルの併用治療に対するLL/2 SC腫瘍の反応
局部的放射線単体または抗PD-1との併用治療後のLL/2 腫瘍
肺癌治療では、放射線治療は一般的に単体で、緩和的単独療法として、さらには化学療法と併用して用いられます。 While focal radiation is highly recommended, we have utilized our RadSource RS-2000 to deliver localized radiation in a few models. 当社の実験した皮下 LL/2モデルでは、仙骨部にインプラントされたSC腫瘍を持つマウスに、一度の高感度(20Gy)限局放射を行いました。放射線のみの治療では評価サイズまでの時間はコントロールグループでは20日から36日に増加することを発見しました。抗PD-1の追加によって、評価までの時間はわずかに増加して38.5日になるだけで、併用治療を追加する利点が無いことを示唆しています(図表6)。しかしながら、放射線、免疫チェックポイント阻害、そして新しい療法の3種併用治療はこのモデルでさらに実験を進めることが可能です。
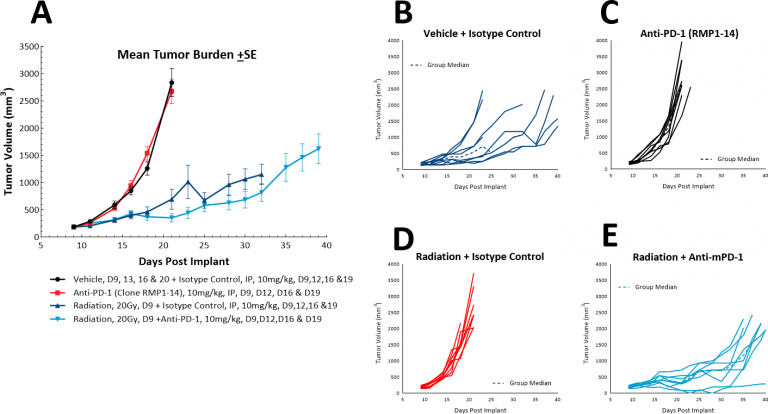
図表6: 限局放射と抗PD-1の併用治療に対するLL/2 SC腫瘍の反応
皮下腫瘍モデルは迅速で比較的簡単な抗腫瘍活動の評価に有用です。 しかしながら、移植場所の性質上、これらの腫瘍はすべての患者の体内で発生している疾患を再現するだけの、必要な生体過程を複製できない可能性があります。この目的のために、当社では同所性肺設定でのLL/2 モデルの開発に使用されている、ルシフェラーゼ対応バージョンのLL/2, LL/2-Luc-M38を用意しています。
LL/2マウス肺癌モデルは前臨床Immuno-Oncologyモデルとして採用が可能です。当社のデータは、このツールが「冷たい」非免疫原性腫瘍の治療に、放射線またはチェックポイント阻害剤と組み合わせた新しい併用治療、あるいは他の新興アプローチに有用であることを示しています。
Please contact us to speak with our scientists about how LL/2 or one of our other syngeneic models can be used for your next immuno-oncology study.
参照
お問い合わせはこちら
お問い合わせ