Date: May 2018
乳癌は米国の女性において最も一般的な癌で、癌による死亡原因の第 4 位を占めています。2017年に新たに肺癌と診断された人は推定 252,710 名(うち 15% が新規癌)、また 40,610 名が肺癌で死亡しました。早期発見のイニシアティブと治療オプションの向上により、全体的な 5 年間の生存率が 1975 年時点の 75% から今日の 90% へと増加しています[1]。生存率の統計は向上しているものの、転移性疾患の治療は引き続き困難であり、その結果死亡に至ることがよくあります。このため、新しい乳癌治療の開発を継続することは不可欠です。
乳癌の Immuno-Oncology 併用療法の使用における前進
ホルモンまたは Her2 によって発生する乳癌を治療するためのオプションはいくつかありますが、これらの的を絞った治療を利用できないトリプルネガティブ乳癌の患者様のオプションは幾分限られています。 さらに、免疫療法は黒色腫や肺癌の治療で成功を収めているものの、乳癌はチェックポイント阻害療法やその他の免疫治療法で治療することが非常に困難であることが分かっています。 However, with the focused effort in recent years towards immuno-oncology approaches to breast cancer, emerging clinical data is showing promise, particularly in combination therapy.[2] To help drive this research forward, we have developed the EMT-6 syngeneic breast tumor model. BALB/c マウスの過形成性腺房結節から派生した [3] このモデルは、マウスの完全な免疫系を使用し、Immuno-Oncology において強力なツールとなります。
EMT-6 モデルを使用した併用療法の試験
乳癌は米国の女性において最も一般的な癌で、癌による死亡原因の第 4 位を占めています。2017年に新たに肺癌と診断された人は推定 252,710 名(うち 15% が新規癌)、また 40,610 名が肺癌で死亡しました。早期発見のイニシアティブと治療オプションの向上により、全体的な 5 年間の生存率が 1975 年時点の 75% から今日の 90% へと増加しています[1]。生存率の統計は向上しているものの、転移性疾患の治療は引き続き困難であり、その結果死亡に至ることがよくあります。このため、新しい乳癌治療の開発を継続することは不可欠です。
乳癌の Immuno-Oncology 併用療法の使用における前進
ホルモンまたは Her2 によって発生する乳癌を治療するためのオプションはいくつかありますが、これらの的を絞った治療を利用できないトリプルネガティブ乳癌の患者様のオプションは幾分限られています。 さらに、免疫療法は黒色腫や肺癌の治療で成功を収めているものの、乳癌はチェックポイント阻害療法やその他の免疫治療法で治療することが非常に困難であることが分かっています。 However, with the focused effort in recent years towards immuno-oncology approaches to breast cancer, emerging clinical data is showing promise, particularly in combination therapy.[2] To help drive this research forward, we have developed the EMT-6 syngeneic breast tumor model. BALB/c マウスの過形成性腺房結節から派生した [3] このモデルは、マウスの完全な免疫系を使用し、Immuno-Oncology において強力なツールとなります。
EMT-6 モデルを使用した併用療法の試験
この「注目のモデル」では、EMT-6 モデルの初期有効性研究からのデータを示します。これらのデータは、さらに研究が実施される中で、新治療法との合理的な併用研究のデザインを可能にします。EMT-6 モデルのコントロール腫瘍の増殖は、図 1 に示されています。平均的な倍加時間は 5.5 日であり、抗腫瘍活性を引き出すために最低でも 3 週間の治療期間が得られます。治療を受けない腫瘍と、アイソタイプコントロール抗体(ラット IgG2b)で治療を受けた腫瘍の腫瘍成長率はほぼ重なります。免疫制御治療への EMT-6 の反応を判断するため、EMT-6 腫瘍を持つマウスをチェックポイント阻止剤 (抗 mPD-1 と抗 mPD-L1)、および共刺激因子である抗 mCD137で治療しました。さらに、乳癌治療には焦点放射線がよく使用されるため、放射線単独治療と併用治療のモデルも加えました。
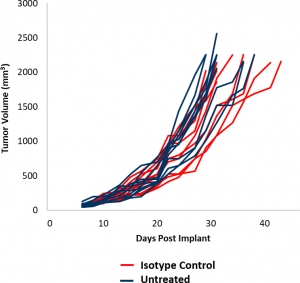
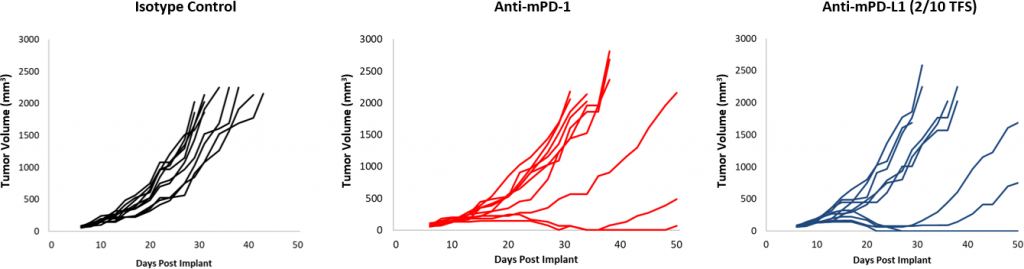
図 2:チェックポイント阻害剤に対する EMT-6 の反応。
チェックポイント阻害剤に対する反応は、コントロールに比べ全体的に穏やかでした (図 2)。一部の動物は反応を示しましたが、抗 PD-1 および抗 mPD-L1 の組み合わせには、まだ改善の余地があります。さらに、10Gy の焦点放射線は、他の同系モデルにおいて腫瘍増殖を大幅に遅延させますが、EMT-6 での作用は穏やかです。この療法に抗 mPD-1 を併用することにより、効果は上がりますが、3 療法併用においてはまだ改善の余地が見られます。 対照的に、抗 mCD137 単独治療は、EMT-6 に対して強い反応(4/10 TFS)を見せています。焦点放射線との併用は、抗 mCD137 単独療法(図 3)と比較して、わずかな向上(5/10 TFS)を見せるのみです。これらのデータは、放射線、チェックポイント阻害剤、副刺激分子作用薬を単独または組み合わせて使用した、2 種または 3 種の併用戦略を調査するために EMT-6 モデルを使用することのメリットを示しています。
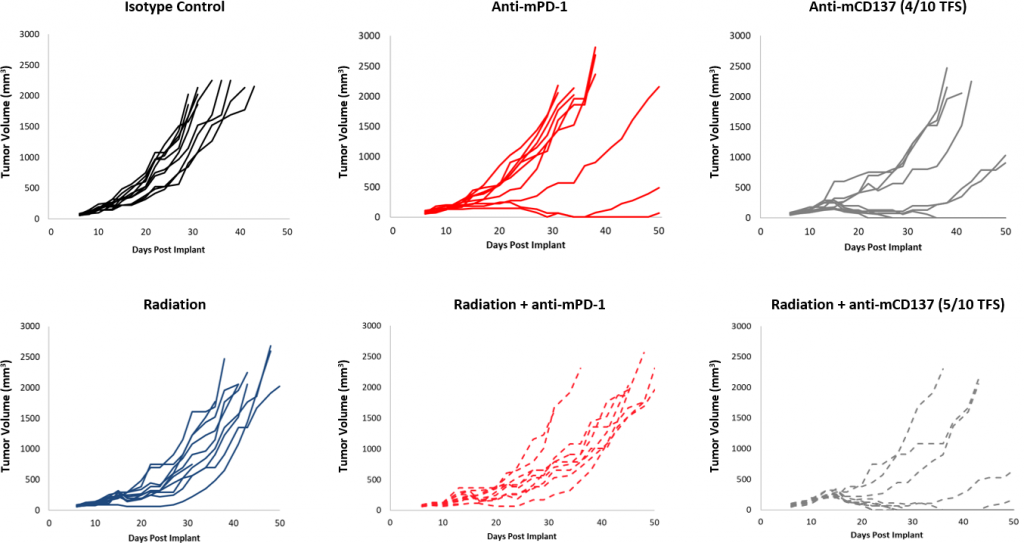
図 3:焦点放射線の併用療法に対する EMT-6 の反応
腫瘍内の浸潤細胞の組成
Immuno-Oncology の目的でモデルを研究する際には、腫瘍内の浸潤細胞の組成を知ることも重要です。よって、220~385 mm3 の間の腫瘍で、合計 CD45+ 細胞として示された (図 4) 湿潤 T 細胞と骨髄細胞を検査しました。すべての腫瘍の骨髄コンパートメントは、M2 マクロファージ、単球性 MDSC、および顆粒球 MDSC に均等に配分されています。M1 マイクロファージ浸潤は、他の骨髄由来細胞に比べて比較的低いものでした。この組成は、免疫抑制微環境を示唆しており、試験を行った大半の免疫療法の反応が限定的であったことを説明するものかもしれません。
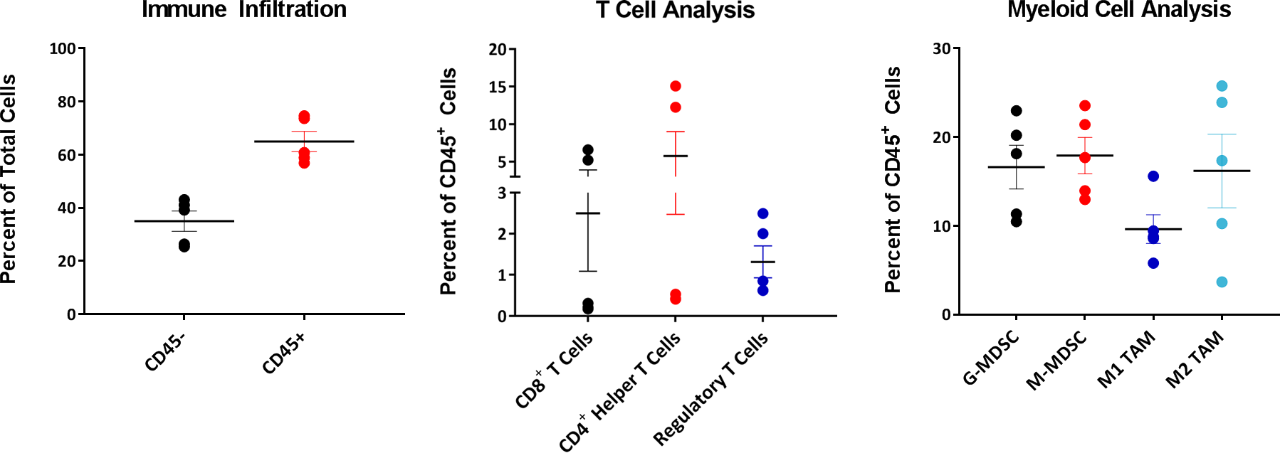
図 4:EMT-6 浸潤 T 細胞および骨髄細胞の分析
対照的に、T 細胞コンパートメントは腫瘍間変動性を見せ、5 つの腫瘍のうち 3 つの腫瘍で CD4+ および CD8+ T 細胞のレベルが非常に低くなっています。興味深いことには、これらの腫瘍の Treg 組成では、CD4+ および CD8+ T 細胞浸潤と比較して、腫瘍間のばらつきが大幅に低くなっています。これらの EMT-6 腫瘍の浸潤 CD4+ および CD8+ T 細胞で見られる変動性が、生物学的にこのモデルに固有のものなのか、それともより大きなサンプルサイズでは変動性が正常化されるものかどうかを判断するため、引き続き研究が行われています。
EMT-6 - 堅実な前臨床 Immuno-Oncology モデル
EMT-6 同系乳癌モデルは、好ましい免疫プロファイルを備え、堅実な前臨床 Immuno-Oncology モデルとして使用できます。当社のデータは、放射線、チェックポイント阻害剤、または副刺激分子を使用した新しい併用療法の調査でこのツールを使用することのメリットを示しています。
MODEL SPOTLIGHT | EMT-6 Syngeneic Breast Tumor Model – A Powerful Tool for Immuno-Oncology Studies (PDF Version)
参照
お問い合わせはこちら
お問い合わせ