Date: December 2020
免疫系の内因性抗腫瘍活性を利用した癌治療法の登場は、オンコロジー治療学におけるパラダイムシフトを意味し、これからの癌との戦い方を永久に変える出来事となりました。
大腸癌(CRC)は癌全体の中でも最も代表的な疾患であり、すべての癌発症例の 10% を占めます。2018年には全世界で百万件以上の新規 CRC 発症事例が報告されており、そのうち 50 万人を超える患者様が死亡しました。1 臨床治療としては外科的切除に続いて、非転移性結腸癌の場合は補助化学療法があり、さらに転移性の CRC に対してはより標的を絞った治療が行われます。2 最近の臨床研究は、高頻度マイクロサテライト不安定性(MSI-H:High Microsatellite Instability)もしくはミスマッチ修復機構欠損(dMMR:Mismatch Repair Deficient)を伴う大腸癌を患い、切除不可能な転移性癌患者様の治療における免疫チェックポイント阻害薬の有効性を示しています。3 臨床上のメリットが非常に大きいことから、キイトルーダ(免疫チェックポイントタンパク質ヒト PD-1 を標的としたモノクローナル抗体)はこれら 3 つの基準を満たし、2020年夏に CRC 患者様に対する一次治療として承認されました。4 CRC に対するこの有望な免疫療法の登場に伴い、Immuno-Oncology 新薬の有効性を評価するため、大腸癌の高度なトランスレーショナル前臨床モデルが必要になります。
免疫系を標的とする治療法の有効性を評価するには、試験薬による影響を観察できるよう、損傷のない免疫システムを持つ前臨床腫瘍モデルが不可欠です。同系腫瘍モデルの戦略は、マウス由来の癌細胞が増殖し、腫瘍細胞由来の免疫担当マウス株で腫瘍を形成するというものです。 We have extensively used CT26.WT murine colon carcinoma as a subcutaneous tumor model in female Balb/c mice to evaluate the efficacy of immuno-oncology agents - see our previous work in the model spotlights below (additional data available upon request):
- CT26 マウス結腸癌について
- 「多色フローサイトメトリーによる CT26 マウス結腸癌モデルにおける複数のリンパ球サブセットでの増殖の特性化」ポスター
- 「抗 mCTLA-4 治療後の CT26 および 4T1-Luc 腫瘍モデルの免疫表現型分析とトランスクリプトーム解析」ポスター
当社は、原発器官から発生する腫瘍とは微小環境が異なる皮下腫瘍モデルの実験的制限やそのトランスレーショナル研究における制約を理解しています。こうした制限や制約の一つとして、異なる免疫細胞プロファイルが免疫療法に対する反応に影響を及ぼすことが挙げられます。5,6 腫瘍細胞を原発組織に移植する腫瘍同所移植は、皮下試験の制約を改善し、モデルの移転性を高めることを目的としています。
このモデルに注目する本稿では、CT26.WT 結腸癌を用いた再現性のある確かな同所マウス腫瘍モデル、信頼性の高い移植外科手技、そしてチェックポイント阻害に対する反応の検証を実証するデータを提示します。
なお、動物を用いた実験はすべて、施設を管轄する動物実験委員会によって承認されており、「Guide for the Care and Use of Laboratory Animals」(実験動物の管理と使用に関する指針)に従って AAALAC 認定プログラムの範囲内で実施されています。また、すべての試験において人道的安楽死の基準があらかじめ定められています。
CT26.WT-luc 腫瘍の同所性増殖
図 1 - Balb/c マウスに同所移植された CT26.WT-luc 由来腫瘍の増殖動態
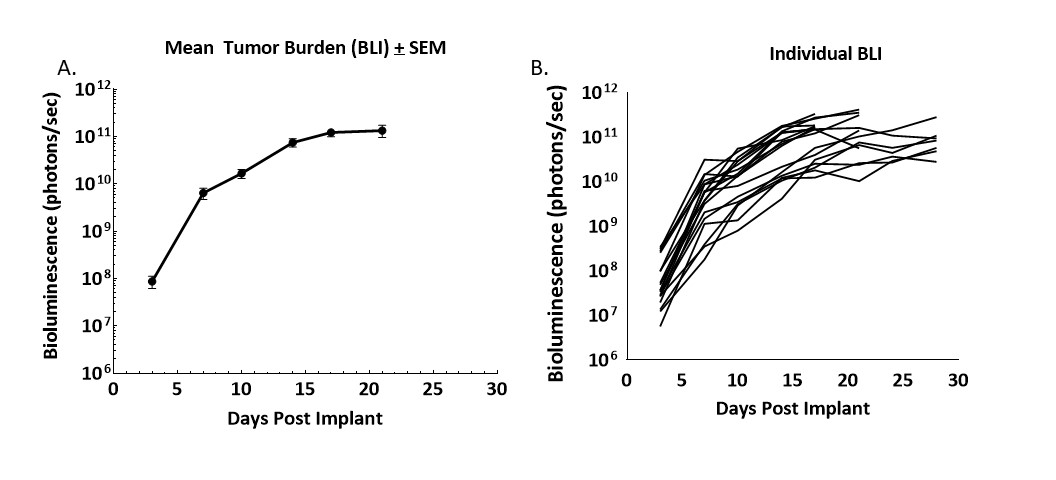
図 1 - 20 Balb/c マウスの生物発光画像化による CT26.WT-luc 腫瘍片同所移植後の腫瘍組織量の長期モニタリング。移植後 3 日目に生物発光を開始、表示は群平均(A)と個別値(B)。
腫瘍組織量は一定の増加を示しましたが、その変化はごくわずかでした。BLI と解剖による腫瘍生着率は 95% で、自然退縮は見られませんでした。また、BLI 由来腫瘍量倍加時間(Td)は 1.5 日間、試験の平均時間は 21 日間でした。
疾患の進行に関する一般的な臨床所見は、腫瘍増殖や体重増加に伴う腹部膨満で(表示データなし)、 解剖の結果、盲腸に大きな原発腫瘤、そして肝臓と腹壁に小結節が確認されました。結腸の原発腫瘍では結腸との大規模な血管統合が確認され、腫瘍による効率的な血管動員が示されました。この次のアプローチは、このモデルを用いた Immuno-Oncology 薬剤の有効性の判定です。
同所 CT26.WT-luc 腫瘍モデルにおけるチェックポイント阻害
前述の通り、ナイーブな Balb/c マウスに CT26.WT-luc 腫瘍片の外科的移植を行いました。 Animals were staged by BLI three days following surgery and distributed into treatment groups based on BLI values. Animals were treated by intraperitoneal administration of 10mg/kg isotype control (clone LTF-2), anti-mPD-L1 (clone 10F.9G2), anti-mCTLA-4 (clone 9D9) or anti-mPD-1 (clone RMP1-14) twice weekly for two weeks. すべての抗体は、BioXCell 社(米国ニューハンプシャー州レバノン)から入手したものを使用しました。そして週 2 回腫瘍組織量の BLI 測定を行い、週 3 回体重を計測して、毎日臨床所見と最終解剖の所見を記録しました。
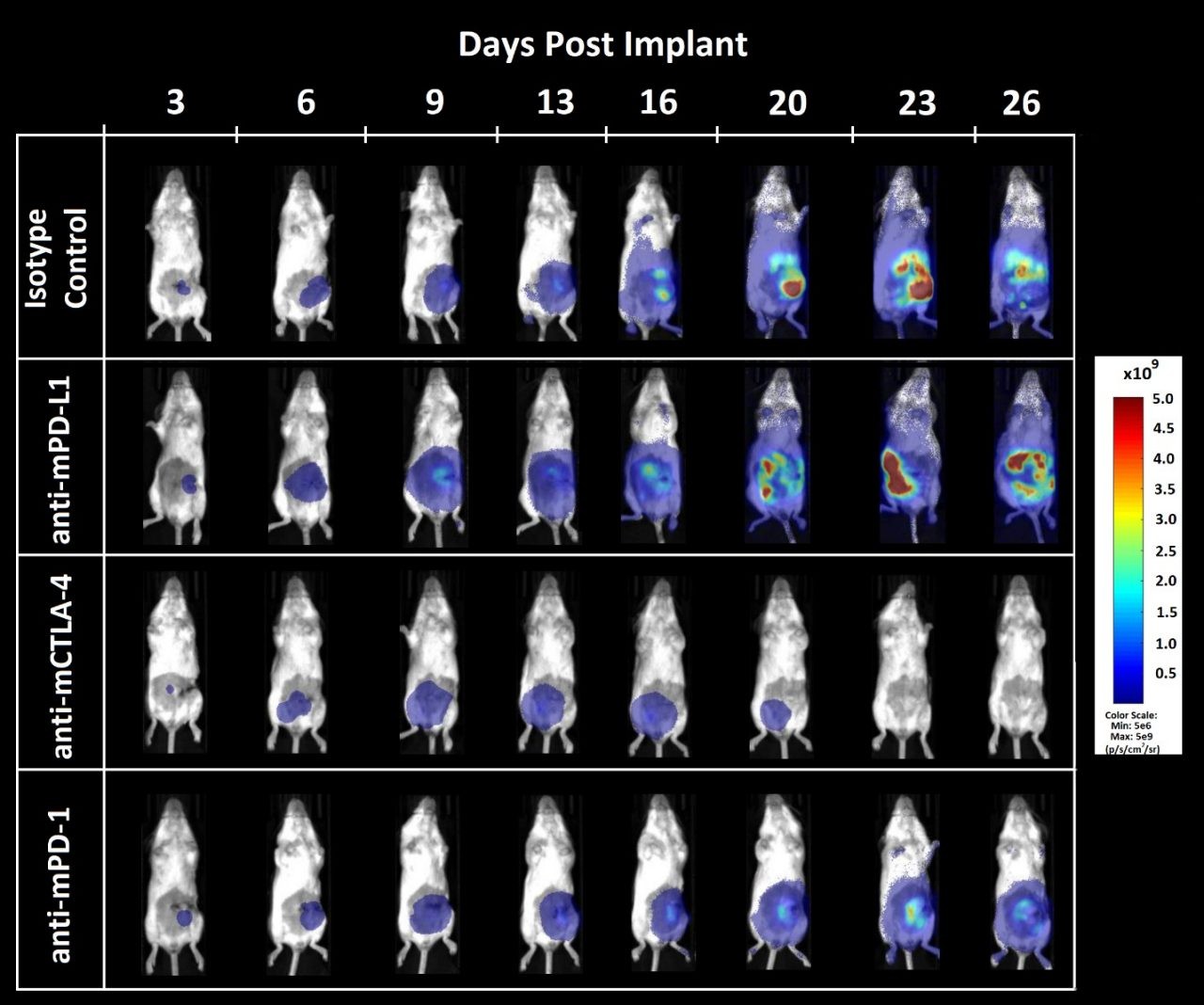
図 2 - チェックポイント阻害抗体に対する同所移植された CT26.WT-luc 腫瘍の反応 BLI(A)による群平均腫瘍組織量の評価および各治療法への反応における各動物の BLI 値(B~E)。
アイソタイプコントロール抗体の投与では、腫瘍組織量や疾患の進行への影響は見られませんでした(図 2A、2B)。アイソタイプコントロールを投与した被験動物の腫瘍倍加時間は 2.2 日間、平均試験期間は 28 日間です。抗 mPD-L1(図 2A、2C)の投与では完全退縮が見られ、基準となる BLI 値を上回る腫瘍組織量は検出されませんでした。抗 mCTLA-4 治療(図 2A、2D)では 23 日目に 0.1% の ΔT/ΔC および 5 回の部分退縮が見られ(治療初日の BLI 値の半分以下)、解剖時に目立った疾患は確認されませんでした。抗 mPD-1 の投与(図 2A、2E)では退縮や無腫瘍生存体はありませんでした。
図 3 - チェックポイント阻害に対する CT26.WT-luc 同所腫瘍反応の生物発光画像化
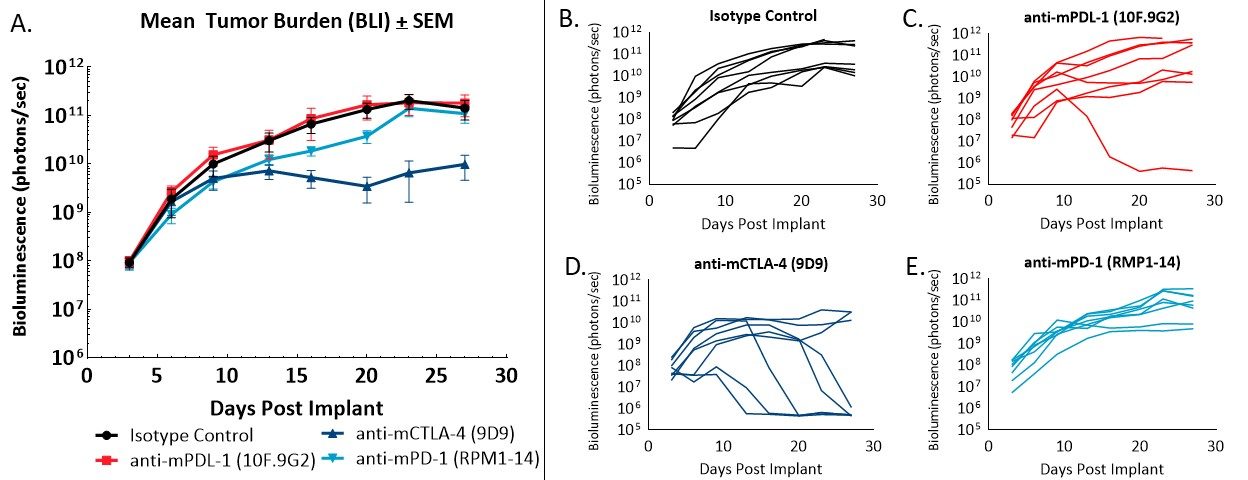
図 3 - 免疫チェックポイント遮断剤を投与されたメスの Balb/c マウスに同所移植された CT26.WT-luc 由来腫瘍の生物発光画像化。図中の被験動物はそれぞれの群の平均 BLI 値を示します。
腫瘍組織量は腹部に局在し、前回の試験的な成長実験(表示データなし)から予想された通り、時間の経過とともに増加(図 3)しました。抗 mCTLA-4 による治療では、疾患による体重増加(データ表示なし)が遅れて始まりました。抗 mPD-L1 または抗 mCTLA-4 の投与では、それぞれ 12.5 日間および 23.6 日間のアイソタイプコントロールにより寿命が伸びました。最終解剖では、抗 mPD-L1 を投与した動物 8 匹のうち 1 匹、ならびに抗 mCTLA-4 を投与した動物 8 匹のうち 5 匹で腫瘍または他の病変の証拠が認められませんでした。
現在は、腫瘍免疫細胞浸潤、組織学的特性、形態学、そしてチェックポイント阻害に対する免疫学的活性化に関して、CT26.WT 移植位置が皮下の場合と同所の場合でどのような違いがあるかを継続的に評価しています。
これらのデータを総合すると、結腸癌の CT26.WT-luc 同所モデルが、高度にトランスレーショナルな移植位置において Immuno-Oncology 薬剤を評価する堅牢なプラットフォームの役割を果たすことが証明されました。
Contact our scientists to learn more about the CT26.WT-luc, and other murine orthotopic tumor models, and how we can apply these tools to advance your oncology pipeline.
参照
1Bray F, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries(2018年の世界の癌統計:GLOBOCAN による、癌 36 種の 185 か国における推定罹患率および死亡率) CA Cancer J Clin 2018; 68:6, 394-424.
2Kuipers E, et al. Colorectal Cancer(大腸癌) Nat Rev Dis Primers. 2015; 1: 15065.
3Tintelnot J, Stein A. Immunotherapy in colorectal cancer: available clinical evidence, challenges and novel approaches(大腸癌の免疫療法:入手可能な臨床のエビデンス、課題、新しいアプローチ) World J Gastroenterol. 2019; 25:29, 3920-3928.
4米国食品医薬品局(FDA) | FDA approves first-line immunotherapy for patients with MSI-H/dMMR metastatic colorectal cancer(FDA が MSI-H / dMMR 転移性大腸癌患者を対象とした一次治療免疫療法薬を承認)、 2020年6月29日プレスリリース
5Devaud C, et al. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy(さまざまな解剖学的部位の組織が腫瘍の微小環境を形成して変化させ、治療に与える反応の可能性について). Mol Ther. 2014; 22:1, 18-27.
6Zhao X, Li L, Starr TK, Subramanian S. Tumor location impacts immune response in mouse models of colon cancer(腫瘍の位置が大腸癌マウスモデルの免疫反応に与える影響について). Oncotarget 2017; 8:33, 54775-54787.
7Fiegle E, Doleschel D, et al. Dual CTLA-4 and PDL-1 blockade inhibits tumor growth and liver metastasis in a highly aggressive orthotopic mouse model of colon cancer(CTLA-4 と PDL-1 の二重遮断が、侵襲性の非常に強い大腸癌同所性マウスモデルの腫瘍増殖・肝転移を阻害). Neoplasia 2019; 21:9, 932-944
お問い合わせはこちら
お問い合わせ