著者:Sumithra Urs 博士 | サイエンティフィック・ディベロップメント部門シニアサイエンティスト
Date: December 2019
皮膚癌は、皮膚のあらゆる層で発症し、一般的なものには基底細胞癌 (BCC: Basal Cell Carcinoma) や扁平上皮癌 (SCC: Squamous Cell Carcinoma) があります。黒色腫や非黒色腫の皮膚癌(メルケル細胞癌、カポジ肉腫、皮膚リンパ腫、その他肉腫)はそれほど一般的ではありません。あらゆる種類の皮膚癌のなかでも、黒色腫は最も深刻で、皮膚表皮の最下層(基底層)のメラニンを産生する神経堤由来細胞であるメラニン細胞で発病します。悪性の基底細胞癌(BCC)や扁平上皮癌(SCC)が転移することはほとんどありませんが、あまり一般的ではない悪性の黒色腫は侵攻性が高く、体内の他の部位に急速に転移します。黒色腫は形状、サイズ、色も様々に異なり、警告となる一連の兆候が伴います。[1]
黒色腫は、早期に発見して治療できれば治癒可能な病気であり、米国の患者の 5 年生存率は推定 98 %です。[2] 黒色腫が皮膚または身体の他の部位に侵攻すると、治療が難しくなり、死に至る場合もあります。米国癌協会(American Cancer Society)は、2019年における米国の黒色腫について、約 192,310 人が新たに黒色腫の診断を受け、そのうち 96,480 件に侵攻性があり、約 7,230 人の患者が死亡すると推定しています。黒色腫の罹患率はここ数十年で急速に増えており、若年成人層(特に若年女性)が最も罹患しやすい癌のひとつです。人種によって免疫があるというわけではありませんが、色白の肌は黒色腫の主なリスク要因であり、アフリカ系アメリカ人と比べて白人は 20 倍多く罹患しています。各人のリスクは、日光への暴露、紫外線、ほくろ、癌の既往歴、遺伝、家系など、いくつかの要因の影響を受けることがあります。
治療方法は、病期、腫瘍の位置、患者様の健康全般などにより異なりますが、外科手術による黒色腫の摘出、免疫療法、標的治療、化学療法、放射線療法などがあります。よく使用される単剤療法では、B-RAF 遺伝子、C-KIT 遺伝子、およびその他の異常遺伝子の変異を標的とします。さらに、ダカルバジン、テモゾロミド、ナブパクリタキセル、シスプラチン、およびカルボプラチンなどの化学療法剤をどれも使用することができます。IL-2、イピリムマブ(CTLA-4 阻害剤)、および ペンブロリズマブやニボルマブ(PD-1 阻害剤)などの免疫療法剤の臨床試験が進められており、積極的に患者様をリクルートしています。これらの免疫調節薬は併用して、また新規免疫補助剤のアプローチでも試験されています。さらに、黒色腫のワクチン、ステージ III 向けの BCG ワクチン、腫瘍溶解性ウイルス(T-VEC)が試験されています。[3] 新しい治療オプションは、進行期の黒色腫を患う患者様の生活の質の向上と生存率の向上に重点を置いています。
マウス B16 黒色腫モデルは、前臨床試験の転移性黒色腫モデルに最もよく使用されます。 We have established the syngeneic B16-F10 model to evaluate responses to immuno-oncology agents and support development of novel therapeutics. B16-F10 細胞株は、C57BL/6 マウスの B 16の親腫瘍の 10 番目の連続継代サブクローンとして形成されました。[4] In vitro で、これらの細胞は上皮形態に付着する集団として成長します。 In vivo で C57BL/6 マウスの B16-F10 細胞を皮内移植すると、侵攻性の高い腫瘍となります。 当社の増殖研究では、広範な接種材料について倍化時間約 2-3 日間経過後、効率的な成長キネティクスが見られます (図 1)。対照動物は、過度な全身腫瘍組織量が安楽死基準に達する 20-25 日前まで研究対象となります。このことから、抗腫瘍活性を引き出す試験剤に最大 2 週間の投与期間を利用できるモデルとなります。モデル自体は体重の減少につながらない一方、腫瘍の痂皮形成および潰瘍形成は、皮下や真皮の B16-F10 腫瘍成長に関連するよくある臨床症状です。
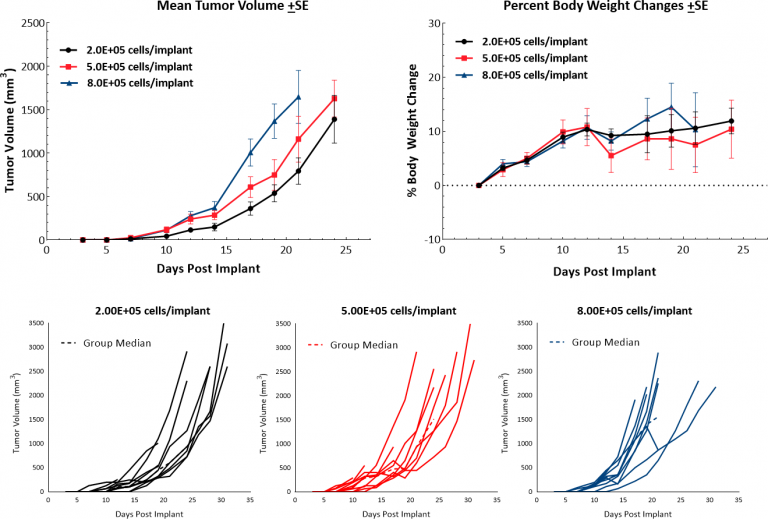
図 1:C57BL/6 マウスへの B16-F10 皮内移植後の成長キネティクスと体重の変化
B16-F10 腫瘍の免疫プロファイル
Baseline immune profiling of B16-F10 tumor infiltrates was determined by flow cytometry on 5 untreated tumors (300-500mm3) and analyzed using the CompLeukocyteTM package. The immune cell infiltration in the tumor microenvironment, represented a percent of CD45+ cells, showed a distinct immune cell population dominated mostly by undefined CD11b+ myeloid cells characteristic to this tumor model (Fig 2). M2 TAM (19%)、G-MDSC (15%) および M-MDSC (11%) は、比較的均等な範囲で示されましたが、M1 TAM (1.4%) と樹状細胞 (4%) の集団は最小限を占めています。リンパ集団はほとんどが B (7.3%) および NK (4%) 細胞からなり、腫瘍への T 細胞浸潤は最小限にとどまります。全体的な免疫プロファイルは、非免疫原性のモデルを示唆しています。
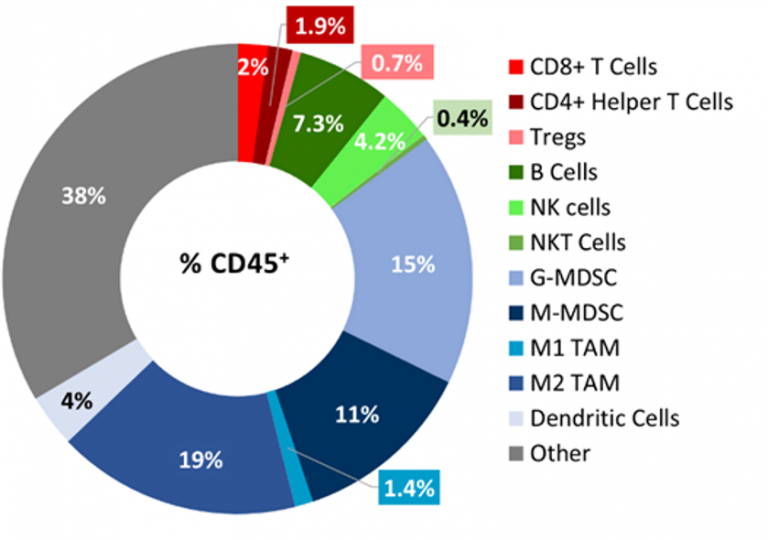
図 2:B16-F10 モデルにおける腫瘍免疫細胞浸潤の免疫表現型検査。
B16-F10 の治療への反応
免疫調整効果:
We have investigated a number of immune modulatory antibodies in this model. 腫瘍が ~90mm3に達した時に、チェックポイント阻害剤抗 mPD-1 または抗 mPD-L1 を使って治療を開始したところ、皮下 B16-F10 腫瘍の反応はありませんでした(図 3A)。同様に、移植後早い場合は 4 日で抗 mCTLA-4 または 抗 mLAG-3 を使って治療を開始しても、まったく反応が見られませんでした(図 3A)。最後に、B16-F10 腫瘍をTNF 受容体群の共刺激受容体 CD137 で治療した際、抗腫瘍活性は見られませんでした(図 3B)。未処置の B16-F10 腫瘍の免疫抑制腫瘍の微小環境を考えると、単剤の免疫調整効果が限定的もしくはまったく反応を引き起こさないことは、驚くに値しません。また、この反応の欠如は、B16-F10 に報告された通り、免疫学上の「Cold」腫瘍モデルを示しています。
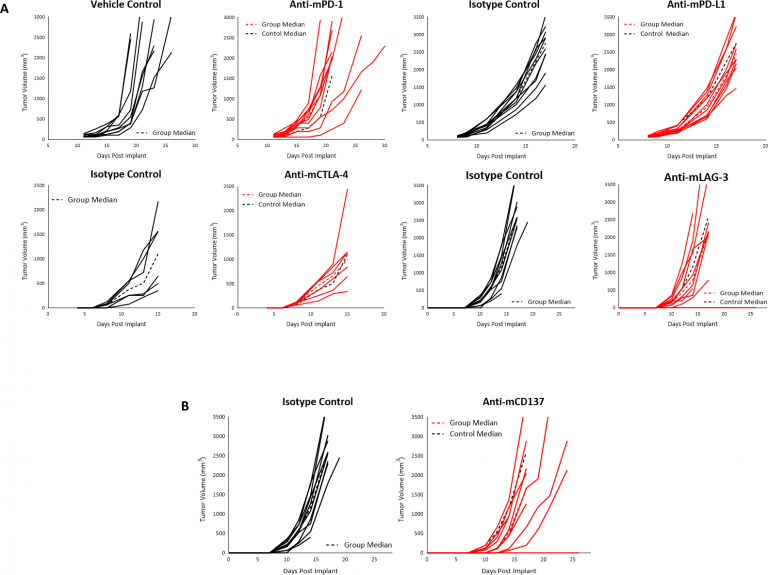
図 3:C57BL/6 マウスにおけるチェックポイント阻害剤 (A)、または抗 mCD137 (B) 治療後の B16-F10 腫瘍の反応。
放射線:
放射線治療(RT)は、患者様が外科手術に適さなかったり外科的処置を拒否する場合に黒色腫の治療に使われます。当社では、Xstrah の小動物放射線研究プラットフォーム (SARRP: Small Animal Radiation Research Platform) による単回照射に対する皮下 B16-F10 腫瘍の感度を評価しました。10、15 または 20 Gy のいずれかの放射線治療は、少なくとも 50% の動物で抗腫瘍活性を示し、10、15 および 20 Gy RT の用量反応としてそれぞれ 5.9 日、14 日または 10.5 日の腫瘍成長の遅れが見られました。これにより、B16-F10 黒色腫モデルは放射線に反応することが示されました(図 4)。しかし、試験で最も高い用量で治療した場合でも、著しい退行または無腫瘍生存にはなりませんでした。このため、前臨床設定での SARRP による焦点 RT は、放射線治療を含む臨床開発への道を模倣するアプローチの組み合わせを評価するのに役に立つ場合があります。
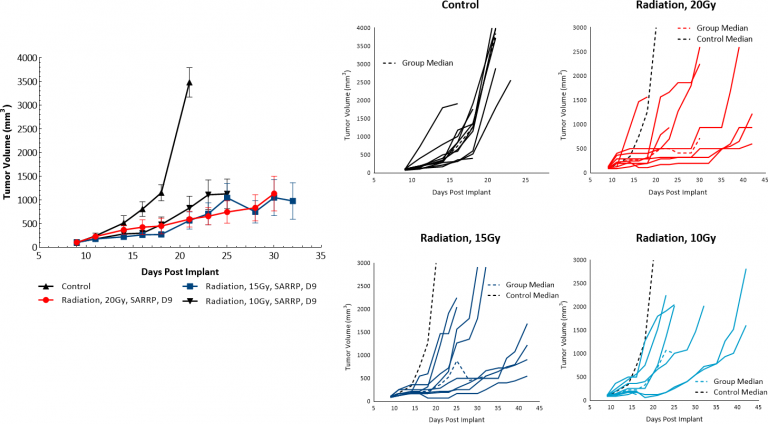
図. 4:C57BL/6 マウスの焦点放射線治療に対する B16-F10 腫瘍の反応。
黒色腫の治療に免疫調節剤と化学療法もしくは放射線治療の組み合わせを用いることは、患者様の反応を改善する可能性があります。[5] さらに、併用療法により、免疫学上「Cold」な腫瘍の性質を、より治療に適すると思われるより受容的 / 反応的な腫瘍の微小環境へ変える一助となる可能性があります。 To discuss how the B16-F10 model would be useful in your next immunotherapy study, contact the scientists.
参照
1https://www.skincancer.org/skin-cancer-information/melanoma/melanoma-warning-signs-and-images/.
2SEER 癌統計ファクト。国立がん研究所、NIH (https://www.cancer.gov)。
3 NCI 黒色腫臨床試験 (https://www.cancer.gov/about-cancer/treatment/clinical-trials/disease/melanoma)。
4 Nakamura K et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Sci. 2002 Jan 4;70(7):791-8. DOI: 10.1016/s0024-3205(01)01454-0.
5 Schwartz AL et al. Antisense targeting of CD47 enhances human cytotoxic T-cell activity and increases survival of mice bearing B16 melanoma when combined with anti-CTLA4 and tumor irradiation. Cancer Immunol Immunother. 2019 Oct 18. DOI: 10.1007/s00262-019-02397-7.
お問い合わせはこちら
お問い合わせ